Os resultados do ensaio da Fase 3 tinham já sido lançados há dois meses pelas farmacêuticas Biogen e Eisai: o lecanemab tinha reduzido o declínio cognitivo e funcional em 27 por cento nos pacientes.
Neste documento,
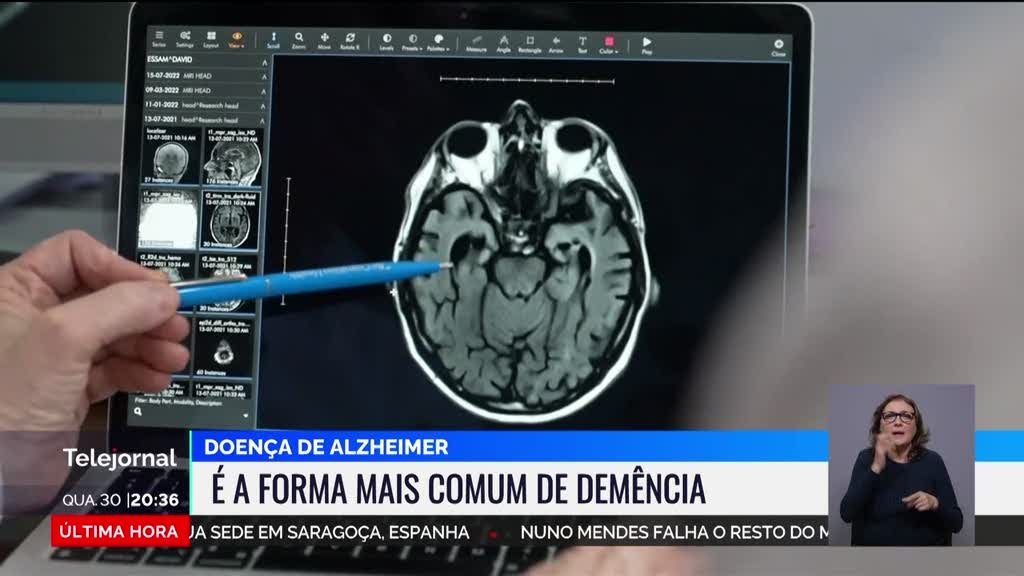
o fármaco experimental é apontado como um tratamento que retarda a progressão do declínio cognitivo na doença de Alzeimer precoce.
“Em pessoas com doença de Alzheimer precoce, o lecanemab reduziu os níveis de amilóide cerebral e foi associado a menos declínio nas medidas clínicas de cognição e função do que o placebo aos 18 meses, mas foi associado a eventos adversos”, escreveram os investigadores. "Serão necessários testes mais prolongados para determinar a eficácia e segurança do lecanemab no início da doença de Alzheimer", sublinharam.
A organização internacional Alzheimer's Association escreveu em comunicado que acredita que esta Fase 3 do lecanemab deu um passo na luta contra a progressão da demência provocada pela doença.
“Esses resultados publicados e revistos por pares mostram que
o lecanemab proporcionará aos pacientes mais tempo para participar da vida diária e viver de forma independente. Isso pode significar muitos meses a mais de reconhecimento dos seus cônjuge, filhos e netos. Os tratamentos que proporcionam benefícios tangíveis para aqueles que vivem com comprometimento cognitivo leve (MCI) devido ao mal de Alzheimer e à demência precoce de Alzheimer são tão valiosos quanto os tratamentos que prolongam a vida de pessoas com outras doenças terminais”, afirma.
Fase 3
O
estudo de Fase 3 foi conduzido em 235 locais nos EUA, Europa e Ásia, durante dois anos, entre março de 2019 e março de 2021.
Envolveu 1.795 adultos, com idades compreendidas entre 50 e 90 anos. Os pacientes apresentavam comprometimento cognitivo leve devido à doença de Alzheimer precoce ou demência leve relacionada com a mesma doença.
Cerca de metade dos participantes foram designados aleatoriamente para receber lecanemab, administrado por via intravenosa a cada duas semanas, e os outros receberam um placebo.
Ao fim de 18 meses de tratamento, os investigadores aferiram que havia diferenças na “classificação de demência clínica”. O grupo do lecanemab progrediu na doença apenas 1,21 pontos, enquanto o grupo que recebeu o placebo atingiu 1,66 pontos.
“As diferenças significativas surgiram logo aos seis meses”, disse o Christopher van Dyck, autor do estudo e diretor do Centro de Pesquisa da Doença de Alzheimer de Yale, durante uma apresentação na Conferência de Ensaios Clínicos sobre a Doença de Alzheimer em São Francisco.
“O tratamento com lecanemab atingiu os objetivos primários e secundários”, afirmou.
Limpeza das amiloides
As amiloides são fibras proteicas que se podem depositar em diversos tecidos. Essas fibras que o organismo não consegue eliminar prejudicam a função desses órgãos.
No caso de os depósitos amiloides acontecerem no cérebro, poderão levar à degeneração dos neurónios provocando perda de memória associada a distúrbios degenerativos.
O lecanemab, um anticorpo monoclonal, atua sobre esses depósitos amiloides.
No início do estudo, o nível médio de amiloide dos participantes era de 77,92 centiloides no grupo lecanemab e 75,03 centiloides no grupo placebo. Aos 18 meses, o nível médio de amiloide caiu 55,48 centiloides no grupo lecanemab e subiu 3,64 centiloides no grupo placebo, revelou o estudo.
“O lecanemab tem o potencial de fazer uma diferença clinicamente significativa para as pessoas que vivem nos estágios iniciais da doença de Alzheimer e suas famílias, retardando o declínio cognitivo e funcional”, observou Lynn Kramer, diretor clínico de doenças de Alzheimer e Saúde do Cérebro em Eisai, com base nesses resultados.
A segurança
Cerca de 6,9 por cento dos pacientes no grupo lecanemab descontinuaram o estudo devido a eventos adversos, em comparação com 2,9 por cento do grupo placebo.
Foram registados eventos adversos graves em 14 por cento do grupo lecanemab e 11,3 por cento do grupo placebo.
Os eventos adversos mais comuns no grupo de medicamentos foram reações às infusões intravenosas e anormalidades em ressonâncias magnéticas, como inchaço cerebral e sangramento cerebral, chamadas anormalidades de imagem relacionadas ao amiloide, ou ARIA.
“Lecanemab foi geralmente bem tolerado. A maioria dos eventos adversos foram reações relacionadas à infusão, ARIA-H e ARIA-E e dor de cabeça”, disse o Dr. Marwan Sabbagh, autor do estudo e professor do Barrow Neurological Institute. Mas acrescentou, sublinhando que tais eventos “foram resolvidos nos meses seguintes”.
O sangramento cerebral ARIA foi observado entre 17,3 por cento daqueles que receberam lecanemab e nove por cento do grupo placebo. O inchaço cerebral ARIA foi documentado em 12,6 por cento com lecanemab e 1,7 por cento com placebo, de acordo com os dados do estudo.
As seis mortes documentadas no grupo lecanemab e as sete no grupo placebo não foram associadas ao tratamento. “Nenhuma morte foi considerada pelos investigadores como relacionada ao lecanemab ou ocorreu com ARIA”, escreveram os cientistas.
O organismo norte-americano que gere as autorizações dos medicamentos - Food and Drug Administration (FDA) - já concedeu “revisão prioritária” ao lecanemab e o medicamento está sob processo de “aprovação acelerada”, de acordo com os laboratórios.
“Espera-se que a FDA decida se concederá aprovação acelerada ao lecanemab até 6 de janeiro de 2023”, diz o comunicado da Alzheimer's Association.